NIEUWSBERICHT
Tijd om wakker te schrikken
Waarom een technische oplossing voor type 1 diabetes hard nodig is
 Dr. Henk-Jan Aanstoot, kinderarts
Dr. Henk-Jan Aanstoot, kinderarts
Diabeter
"The beginning of the end of fingersticks' ~ In 10 jaar tijd zal iemand met type 1 diabetes minstens 20.000 keer in zijn/haar vingers prikken om een bloedglucosewaarde te meten. Hoe onmisbaar het vingerprikken ook geweest is in het management van deze ziekte, het vormt een barrière voor een optimaal en op een individu aangepast management van diabetes,.. en ook voor hun welzijn"
Song, Steinhubel, Topol, The Lancet 2018, 392:21 July doi.org/10.1016/S0140-6736(18)31576-9
Dit is het begin van een artikel in 'The Lancet', een toonaangevend medisch-wetenschappelijk weekblad. Het geeft goed weer dat vingerprikken een 'must' was, maar ook een belasting.
Heeft u al getekend?
Momenteel loopt de petitie om te tekenen voor 'De glucosesensor is geen gadget, maar bittere noodzaak'. Ik ben het geheel met die stelling eens en heb ook getekend als 'professional' die vooral met type 1 diabetes (T1D) bezig is. Ik vind het belangrijk om hier te vertellen waarom ik dat vind. Dat heeft natuurlijk met deze stelling te maken die ook duidelijk aangeeft dat het bij sensoren (RT-CGM en Flash) niet om 'gemak' gaat, maar om het, zonder significante barrières, kunnen bereiken van een adequate behandeling van een ernstige ziekte. En tussen twee haakjes… dat aantal van 20.000 haalt een kind (waar 10x per dag meten vaak normaal is) al in ruim 5 jaar…) Het gaat trouwens niet alleen om type 1 diabetes. Mensen met andere vormen van diabetes die met regelingsproblemen te maken hebben of ook insuline nodig hebben zouden om vergelijkbare redenen in aanmerking moeten komen voor sensorgebruik. Waar in dit stuk 'type 1 diabetes (T1D) staat kun je ook MODY, monogenetische diabetes CF gerelateerde diabetes, type 2 diabetes lezen zeker als daarbij insuline moet worden gebruikt.
Meer metingen werkt!
We weten al tientallen jaren dat een goede glucoseregeling problemen in het 'nu' en de 'toekomst' bij mensen met type 1 diabetes voorkomt (1). En we weten ook een tiental jaren dat vaker per dag meten tot een betere glucoseregeling leidt (2-8). (Tussen twee haakjes… de huidige richtlijn adviseert tenminste 6 tot 10 keer per dag meten en noemt het voordeel van meer bloedsuikerwaardes bij gebruik van een sensor (9)).Daarnaast is er een een directe relatie tussen de kans op acute- en chronische complicaties en de tijd die je buiten de 3,9-10 mmol/l zit (time-in-range, TIR) (10).
Natuurlijk is niet elke nieuwe techniek direct voor iedereen de beste en meest geschikte oplossing, maar ik zal in dit stuk laten zien waarom we ons met elkaar zoveel als mogelijk is moeten inzetten op een betere uitkomst van type 1 diabetes. En daarbij zal blijken dat veel meten de norm moet zijn en de glucosesensor daardoor inderdaad GEEN gadget is maar NOODZAAK. En bovendien dat dit voor IEDEREEN geldt!
Voor wie met type 1 diabetes deze sensor van belang is? Voor iedereen!
Het lijkt dus logisch dat als veel meten van groot belang is en nu de techniek eindelijk zover is dat we op een acceptabele manier continue of vele keren per dag kunnen meten, we deze techniek volop gaan gebruiken. Waarbij we en passant ook de nachtwaardes meten zonder wakker te moeten worden!
Maar dat is niet het geval. Waar in landen om ons heen de wetenschappelijke bewijsvoering en de bijkomende voordelen voldoende bleken voor een grootschalige invoering, met inmiddels grootschalig succes, is het bizar dat in Nederland deze bewijsvoering en voordelen als onvoldoende wordt gezien. Gevolg: deze techniek is niet voor iedereen beschikbaar of moet zelfs weer gestopt moet worden. Kinderen kunnen bijvoorbeeld gebruik maken van FGM-sensoren. Maar op je 18e verjaardag vervalt die mogelijkheid. (Tussen twee haakjes,… wat zou u er van vinden om na één jaar succesvol autorijden de veiligheidsriem te moeten inleveren of de airbag inactiveren?).
Nu horen we uit het onderzoek van Prof. Henk Bilo en anderen dat de in andere landen getrokken conclusies ook hier worden bevestigd. Als we echt ellende, leed, kosten en complicaties nu en later door type 1 diabetes willen voorkomen is gebruik van glucosesensoren (in welke vorm dan ook) en het omarmen en breed inzetten van nieuwe technologische oplossingen voor type 1 diabetes de beste investering en ook de veiligste. De discussie voor wie met type 1 diabetes deze sensor van belang is, doet daarbij mijns inziens niet ter zake: het nut van veel metingen geldt voor iedereen.
Heeft u al getekend? Zo niet ga naar de site en teken vandaag nog!
(Tussen twee haakjes:… nu hebben we het nog vaak over FGM (Flash Glucose Measurement, de Libre, de swipe-methode) en RT-CGM (Real-Time Continuous Glucose Measurement). Maar met de technische ontwikkelingen (Libre 2, Dexcom G7, etc) is er binnenkort waarschijnlijk geen verschil meer en zijn dat allemaal min of meer RT-CGM. Ze genereren allemaal continue gegevens en laten die zien. Belangrijker worden andere aspecten van een sensor als precisie, levensduur, grootte en vooral of en hoe je de sensor combineert met je insulinetoediening (smart pomp/smartpen). En hoe je die toepast in de communicatie met je behandelteam.
Nu en later
Een goede regeling van de glucosewaarde is belangrijk voor nu en later. In het 'nu' zit dat als volgt: type 1 diabetes is een lastige ziekte die continue aanpassingen vereist. Niet zoals bij sommige ziektes een pil nemen en dan weer een tijdje niets hoeven doen ('fire and forget.')… Het ontbreken van de natuurlijke glucosesensor maakt dat je vele keren per dag moet aanpassen, opletten, meten, ingrijpen, stoppen met wat je doet, eten als je niet wilt, het toch weer anders doen, etc etc.(Tussen twee haakjes, dit vergeten we vaak, maar de betacel maakt niet alleen insuline! Ook daar zit altijd al een sensor in die per seconde de glucose regelt! Type 1 diabetes is dus niet alleen een probleem van een absoluut insulinetekort maar ook van een absoluut sensortekort!
 Dat is moeilijk en lastig. En het niet doen heeft direct gevolgen: te hoog en te laag beïnvloeden je concentratie, je gedrag, je prestaties, je slaap, je humeur, je leven. Gevolg is dat deze ziekte ook een forse psychologische en psychosociale belasting geeft: bij Diabeter gaf 30% van de ouders van kinderen met type 1 diabetes (basisschool) aan dat ze minder moesten gaan werken. Een aantal moest zelfs stoppen. Studies laten zien dat problemen met angsten (met name voor ernstige hypo's, complicaties e.d.), depressies en andere psychologisch en psychosomatische aandoeningen vaak voorkomen (11, 12). Verder is verzuim van school of werk verhoogd, wisselen mensen met type 1 diabetes vaker (onvrijwillig) van baan en hebben ze, zelfs in westerse landen, een lager inkomen dan hun identiek opgeleide leeftijdsgenoten (13-18).
Dat is moeilijk en lastig. En het niet doen heeft direct gevolgen: te hoog en te laag beïnvloeden je concentratie, je gedrag, je prestaties, je slaap, je humeur, je leven. Gevolg is dat deze ziekte ook een forse psychologische en psychosociale belasting geeft: bij Diabeter gaf 30% van de ouders van kinderen met type 1 diabetes (basisschool) aan dat ze minder moesten gaan werken. Een aantal moest zelfs stoppen. Studies laten zien dat problemen met angsten (met name voor ernstige hypo's, complicaties e.d.), depressies en andere psychologisch en psychosomatische aandoeningen vaak voorkomen (11, 12). Verder is verzuim van school of werk verhoogd, wisselen mensen met type 1 diabetes vaker (onvrijwillig) van baan en hebben ze, zelfs in westerse landen, een lager inkomen dan hun identiek opgeleide leeftijdsgenoten (13-18).
Van nu naar later: de uitkomsten van type 1 diabetes zijn onvoldoende
Er zijn naast de hierboven gegeven redenen rond het 'nu' ook belangrijke redenen rond 'later'. In tegenstelling tot wat nogal wat mensen denken, is type 1 diabetes een zeer ernstige ziekte waarvan de uitkomsten op lange termijn nog onvoldoende zijn. Slechts één op de drie haalt bijvoorbeeld een glucoseregeling (uitgedrukt in HbA1c) die hen in de veilige zone brengt voor complicaties (19). Geen leuk nieuws wat hieronder volgt, maar harde feiten. Of je nu mens met diabetes, behandelaar, (farma/technologie)industriemedewerker of verzekeraar bent: Kijk naar de cijfers en zie dat een sensor slechts een eerste stap is voor veel mensen naar een betere behandeling, een technische oplossing en naar uiteindelijk een toekomst zonder complicaties.
Bij het leven hoort de dood, maar liever niet te snel of door type 1 diabetes
Veroudering is onontkoombaar en treft iedereen. Door alle vooruitgang kunnen we nu al ruim tachtig jaar worden. De kunst van lang leven (met of zonder type 1 diabetes is om te zorgen dat je niet te snel van binnen veroudert. Dat kunnen wij mensen namelijk, versneld verouderen, door bijvoorbeeld te roken, een hoge bloeddruk of overgewicht te hebben, te veel te zitten ('het nieuwe roken') of door te veel 'slecht vet' of te veel glucose in je bloed hebben. Veroudering gaat, als je deze factoren hebt (en zeker bij een combinatie ervan) gewoon stukken sneller en dat levert oude en gammele bloedvaten op. En dat geeft wat we complicaties noemen: vaatproblemen van kleine vaten in organen (nier, netvlies/oog, zenuwen: microvasculair) en vaatproblemen in hart en grote vaten (met infarcten, beroertes, amputaties tot gevolg: macrovasculair).
Versneld verouderen = eerder dood
Een onvoldoende glucoseregeling is dus een manier om versneld te verouderen en kans te lopen op deze complicaties. Sinds 1993 weten we 'officieel' dat bij type 1 diabetes de mate van glucoseregeling de kans op complicaties, en daarmee ook vervroegde veroudering, ziekte en dood, sterk bepaalt. Hoe beter de regeling, hoe minder complicaties en hoe gezonder je oud wordt. Maar het is moeilijk, zo niet onmogelijk om, wat de betacel in de alvleesklier per seconde kan sturen, met een beperkt aantal (4,6,8,10,..) metingen en momenten per dag precies zo na te doen. Dat is enorm veel werk, waar ondanks de grote inzet van mensen met diabetes lang niet altijd de juiste glucoseregeling uit komt. Het gevolg is dat lang niet iedereen die gewenste glucoseregeling kan bereiken, met alle risico's van dien. Terwijl we de ellendige uitkomsten die je hieronder leest, grotendeels kunnen inperken door een betere glucoseregeling en een betere behandeling.
Type 1 diabetes: helaas harde feiten…..
- Type 1 diabetes neemt nog steeds toe in aantallen en impact: In Europese landen stijgt het aantal patiënten met z'n 3-5% per jaar (20). Wereldwijd zijn er 1 miljoen kinderen en jongeren (0 tot 20 jaar) met type 1 diabetes, geen onbelangrijke aandoening, met een grote impact op leven, leed en kosten.
- Bij onvoldoende regeling van je type 1 diabetes zal je gemiddeld 12 jaar korter leven en de laatste jaren met complicaties. Ernstige en levensbedreigende complicaties zijn vooral hart- en vaatziektes en nierfalen. Deze kunnen 10-30 jaar na de diagnose gaan optreden (21, 22). Mensen met type 1 diabetes hebben daardoor een kortere levensverwachting ten opzichte ven de rest van de bevolking (23-25). In de periode 1995-2005 was dat zo'n 12 jaar gemiddeld korter leven met daarvoor complicaties en verbonden problemen.
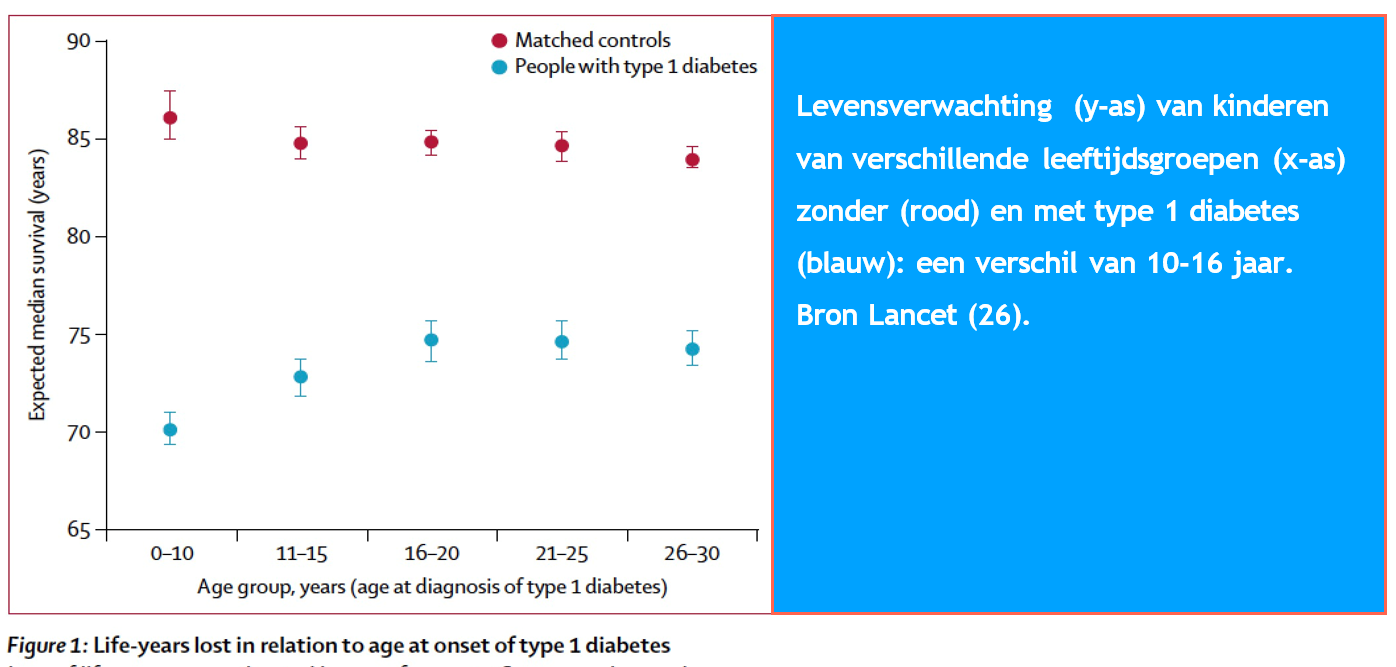
- Hoe jonger je bent bij de diagnose hoe korter je leven kan worden. Recent toonden gegevens uit Zweden (26), een land met vergelijkbare diabeteszorg als Nederland, dat over de periode 1998-2012 de levensverwachting van kinderen die op jonge leeftijd type 1 diabetes ontwikkelden (< 10 jaar oud) 16 jaar korter was. Sinds 2012 zijn er verbeteringen, maar we zijn er nog niet.
- Psychologische effecten: Hoe complex de behandeling in het dagelijks leven ook nu nog is zie je niet alleen aan het veelvuldig voorkomen van psychologische en psychosociale problemen die met de aandoening gepaard gaan (11, 27, 28) en de impact op het leven als hierboven bij het 'nu' genoemd.
- Betere zorg noodzakelijk! Diverse studies laten zien dat in de meeste westerse landen slechts een derde van de jongeren en volwassenen de doelstelling haalt om een HbA1c onder de 7.5% /58 mmol/mol(kinderen) of 7.0% /54 mmol/mol te halen (19). En nu zijn die doelstellingen om hieronder verder genoemde redenen ook nog verscherpt naar 7.0 (54 mmol/mol) en 6.5% (48 mmol/mol). Gelukkig zien we verbeteringen plaatsvinden en in Zweden, Duitsland en ook onze eigen Diabeter data zien we nu meer dan 50% van de mensen het doel halen (19, 29).
- Hart- en vaatziektes: type 1 diabetes is helaas 'hofleverancier' voor hart en vaatziektes als hartinfarcten, beroertes en vaatproblemen aan de benen (met amputaties tot gevolg). De kans hierop is 4 tot 10x zo groot als in de bevolking: gemiddeld 4x (30), maar bij langdurig slechte regeling (HbA1c langdurig > 9% > 75 mmol/mol) 10x vaker (31). Bij een optimale regeling (HbA1c < 7.0 < 53 mmol/mol) blijft die kans verhoogd, mogelijk door het effect van schommelingen (31). In vergelijking met type 2 diabetes (1.2-1.4 x vaker dan in bevolking) zijn verbeteringen daarin nog grotendeels uitgebleven (32, 33).
- Slecht voor het brein: naast de effecten van schommelingen en hoge/lage glucosewaardes op het brein in het 'nu', zijn langdurig hoge glucosewaardes ook geassocieerd met een grotere kans op dementie later in het leven (34).

De ziekte eist zo zijn tol. En dat terwijl eigenlijk iedereen met type 1 diabetes zijn best doet en het beste wil. Maar de complexiteit en onzekerheden in de behandeling leveren frequent frustraties op, vooral ook door dat wat je geleerd hebt en wat je toepast lang niet altijd klopt, uitkomst of werkt. Of doordat de behandelingen of de begeleiding simpelweg nog tekort schieten. Dan kan het een behoorlijke opgave zijn om de motivatie om dag in dag uit voor altijd een goede glucoseregeling te zorgen.
Dat kan alleen met het juiste gereedschap (techniek) (Tussen twee haakjes:…ophouden svp met die achterlijke term hulpmiddelen… je kunt echt niet zonder deze zaken of moeten we weer naar de uitkookbare insulinespuit?!) , maar daarvoor is ook andere diabeteszorg nodig. Natuurlijk, je bepaalt als mens met diabetes en behandelaar gezamenlijk over welke stappen voor jou, wanneer en hoe het beste zijn. Maar gebruik daartoe (aan beide kanten van de tafel) wel alle gegevens.
Continue glucosemetingen als eerste stap naar een oplossing
 Dit zijn ernstige feiten. Willen we daar wat aan doen en de uitkomst verbeteren dan is het eerste recept daarvoor klaar: de patiënt in de gelegenheid stellen meer metingen te gebruiken. Natuurlijk, dat werkt alleen als je met die metingen ook wat doet; je glucoseregeling aanpassen, trends gaan herkennen, insuline aanpassen etc, dus moet de de zorg voor die patiënten ook aanpassen. Dus geen bezoek per drie maanden, maar 'cloudcare' zoals wij dat noemen: afspraken over wanneer wie naar welke gegevens kijkt en hoe. Kan ik het zelf? Heb ik m'n team nodig? Welke stap is nu slim? Afspreken r wanneer langskomen nuttig is, afspraken over hoe bepaalde onderwerpen weer opnieuw of uitgebreider (educatief) moeten worden besproken, etc. Dat is nu exact waar sensortechniek komt helpen. Meer getallen is meer weten en meer weten (dus meten) leidt tot een betere glucoseregeling.
Dit zijn ernstige feiten. Willen we daar wat aan doen en de uitkomst verbeteren dan is het eerste recept daarvoor klaar: de patiënt in de gelegenheid stellen meer metingen te gebruiken. Natuurlijk, dat werkt alleen als je met die metingen ook wat doet; je glucoseregeling aanpassen, trends gaan herkennen, insuline aanpassen etc, dus moet de de zorg voor die patiënten ook aanpassen. Dus geen bezoek per drie maanden, maar 'cloudcare' zoals wij dat noemen: afspraken over wanneer wie naar welke gegevens kijkt en hoe. Kan ik het zelf? Heb ik m'n team nodig? Welke stap is nu slim? Afspreken r wanneer langskomen nuttig is, afspraken over hoe bepaalde onderwerpen weer opnieuw of uitgebreider (educatief) moeten worden besproken, etc. Dat is nu exact waar sensortechniek komt helpen. Meer getallen is meer weten en meer weten (dus meten) leidt tot een betere glucoseregeling.
Maar kan iedereen daar wel wat mee, met al die techniek?
Velen, maar niet iedereen, staan nu in de rij voor een glucosesensor. Uit andere landen waar dit al 2 tot 4 jaar de gebruikelijke behandeling is, weten we dat in de eerste twee jaar meer dan tweederde over gaat naar Flash Glucose Monitoring en RT-CGM en dat percentage neemt daarna verder toe. In Duitsland gebruikte vorig jaar de helft van de 300.000 mensen met type 1 diabetes FGM en 15% RT-CGM. In Belgie idem. Inmiddels is in deze landen het aantal verkochte glucosestrips op z'n retour ((35). In zowel Duitsland en België zijn ook duidelijke afspraken over wie er niet met een (FGM of RT-CGM) sensor gaat meten (bijvoorbeeld als je minder dan 4 metingen per dag wenst te doen, geen interesse in vaker meten, etc) en welke. Bij de neiging tot het niet voelen aankomen van hypoglycemieën is een sensor met koppeling aan een insulinepomp namelijk te prefereren. Er bestaan ook gestructureerde educatieprogramma's die een positief effect geven op het gebruik en het toepassen (36) en afspraken die kunnen resulteren in het stoppen van de sensor.
Resultaten? Zeker: na eerst in studieverband data die al positief waren, werden vele (>80) onderzoeken gepubliceerd (RT-CGM en FGM) zijn nu ook meer 'real-life' data beschikbaar: lagere HbA1c's, minder opnames, minder ernstige hypo's, betere kwaliteit van leven(7, 37-40) en ook kosteneffectief in meerdere onderzoeken (41-49).
Techniek en diabetes: coproductie
Inmiddels blijkt bij al deze technische ontwikkelingen ook hoe belangrijk de samenwerking tussen patiënten en behandelteam is. Duidelijk wordt dat verdere verandering van de huidige diabeteszorg nodig is voor optimaal gebruik en betaalbaarheid van technologie (50). Met een goede basis-educatie en duidelijke plannen voor gebruik en evt. stoppen is in verschillende landen het gebruik van een sensor (FGM en RT-CGM) onderzocht en nuttig gebleken (39, 51-65). Echter, in landen waar dergelijke technieken niet aan continue zorg en educatie zijn gebonden, zoals de VS, is dat een ander verhaal. Daar heeft onder meer de type 1 diabetes Exchange Network, een samenwerking van vele klinieken, al een aantal jaren onderzoek gedaan over de uitkomst van zorg (HbA1c ) en de rol van techniek daarbij. In de afgelopen meetperiode (2016 en 2018) werd in vergelijking met eerdere jaren een forse toename gezien van gebruik van technische middelen als pomp en sensor. Dat steeg van 6% naar 34%, maar dat ging niet gepaard met een betere diabetesregeling (HbA1c) (66). Opvallend daarbij is echter dat 60-80% van deze techniek gebruikers nooit een upload met gegevens deelden met hun team! Diabeteszorg blijft teamwerk waarin regelmatig contact, op welke manier dan ook, de bouwstenen vormen. Van slimme eHealth tot en met traditionele poli-bezoek, het samen vaststellen van behandeldoelen en de kennis en kunde van patient en team, samenkomend in jaargesprek en shared-decision.
Heb je type 1 diabetes en wil je dr. Aanstoot vragen stellen? Of wil je weten wat Diabeter voor jou kan betekenen?
Kom dan naar onze open avond op 21 mei in Eindhoven.
--> meer info / aanmelden
Techniek stopt niet bij RT-CGM en FGM
Een belangrijk punt is dat de glucosesensor slechts een onderdeel van de behandeling is. Voor de vele data die de sensor geeft, is niet alleen andere goede zorg voor de patient nodig, maar moeten we ook stappen nemen naar een eenvoudiger behandeling. Ook daartoe is IT en techniek de volgende stap. Nu kennen we al een tijdje de combinatie van een pomp die met een sensor 'praat' en kan voorspellen wanneer er een hypoglycemie dreigt te ontstaan. In die situatie stopt de insulinetoevoer tijdelijk (predictive low glucose suspend, PLGS) en wordt een hypo voorkomen. Dit is succesvol toegepast en voorkomt niet alleen veel hypoglycemieën, maar brengt ook een betere regeling. Een regeling met een betere time-in-target en minder fluctuaties) (67-70). Zeer fraai zijn de effecten van een sensor bij (pre)zwangerschap (71, 72), waarover binnenkort een uitvoerige blog.
Sensor EN pomp: de toekomst
Uit steeds meer recent onderzoek komt naar voren dat behandeling met een insulinepomp uiteindelijk een betere regeling en toekomst geeft dan met pen-injecties (66, 73, 74). De logische stap om de insulineafgifte door insulinepomp aan de glucosewaarden die de sensor meet te koppelen is dus al enige tijd gezet met de PLGS-systemen. Maar ook het vervolg is er. Inmiddels is er één pomp (Medtronic, Minimed 670G),maar binnenkort meer (Tandem Control-IQ (75), Insulet (76, 77), Diabeloop (78)) op de markt met een nog verdergaande techniek: hybrid closed loop, afgekort de HCL. Waar de PLGS techniek alleen beschermt tegen hypo's, kan de HCL al grotendeels de glucosewaarde binnen nauwe streefwaarden houden (doelwaarde 6.7 mmol/l, time in range 75-90% van de tijd) in een automatische stand. Deze technologie toont grote verbeteringen in glucoseregeling. Je bereikt er een scherpe regeling zonder hypoglycemieën mee, ook bij kinderen vanaf 4 jaar (79-82). Hybrid closed loop kan met adequate educatie, verwachtingsmanagement en aanpassingen in het diabeteszorgsysteem voor veel mensen een verbetering van de regeling en versimpeling van de behandeling betekenen.
Gehackte insulinepompen
Onder de forse druk die patiënten verenigd in #wearenotwaiting /OpenAPS hebben bereikt (83-85) met hun gehackte insulinepompen, sensoren en door hen gemaakte perfecte software heeft de Amerikaanse overheid (FDA) nu besloten dat pompen, sensoren en software bij voorkeur een certificaat krijgen waarmee hun onderlinge uitwisseling is gegarandeerd om samen te werken. Dergelijke eerste zgn. ACE pompen en iCGM (Sensoren) zijn nu beschikbaar. Over een tijd ontstaat daarmee de mogelijkheid om op maat gemaakte intelligente software te koppelen met de meest geschikte/gewenste pomp of sensor. De sensor lijkt dus ook een 'blijver', de glucosestrip is bijna aan zijn laatste levensfase begonnen. Tijd voor 'happy fingers!
Tussen twee haakjes:…..Type 1 diabetes (en andere vormen) is een ernstige aandoening. 'Een beetje suiker' bestaat niet. En 'iemand met 'zwaar suiker' is slachtoffer van een behandeling die helaas onvoldoende was, door welke reden dan ook.
Met veel wetenschappelijke data, met positieve besluiten in landen om ons heen en met nu Nederlandse wetenschappelijke data die een betere regeling (significante daling HbA1c), minder ernstige hypo's, minder opnames, minder arbeidsuitval, betere kwaliteit van leven laten zien, moet het toch logisch zijn om de sensor voor alle mensen met diabetes te vergoeden.
 Immers, de ziekte is ernstig, de gevolgen zijn groot als je onvoldoende mogelijkheden hebt of krijgt om je diabetes te regelen, en de oplossing is daar: meer metingen is meer zien is meer kunnen. Of zoals Cruijff zei: als je goed kijkt , kun je een hoop zien……. De sensor werkt net zo.
Immers, de ziekte is ernstig, de gevolgen zijn groot als je onvoldoende mogelijkheden hebt of krijgt om je diabetes te regelen, en de oplossing is daar: meer metingen is meer zien is meer kunnen. Of zoals Cruijff zei: als je goed kijkt , kun je een hoop zien……. De sensor werkt net zo.
Teken als je het daar mee eens bent, zorg voor happy fingers voor een happy future!
Mei 2019, Henk-Jan Aanstoot, kinderarts Diabeter
Over Diabeter:
Wij zijn een gespecialiseerd behandelcentrum voor type 1 diabetes met vestigingen in Rotterdam, Eindhoven, Groningen, Deventer en Schiphol. Onze missie voor onze meer dan 2500 patiënten met diabetes type 1 is: een toekomst zonder diabetescomplicaties. Alles in Diabeter staat in dienst van deze missie: onze gespecialiseerde artsen, onze ehealth, onze 24/7 bereikbaarheid en onze research naar diabetes type 1.
Heb je type 1 diabetes en wil je dr. Aanstoot vragen stellen? Of wil je weten wat Diabeter voor jou kan betekenen?
Kom dan naar onze open avond op 21 mei in Eindhoven.
--> meer info / aanmelden
Bibliografie
1. DCCTstudygroup. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. The Diabetes Control and Complications Trial Research Group. The New England journal of medicine. 1993;329(14):977-86.
2. Garg SK, Kelly WC, Voelmle MK, Ritchie PJ, Gottlieb PA, McFann KK, et al. Continuous home monitoring of glucose: improved glycemic control with real-life use of continuous glucose sensors in adult subjects with type 1 diabetes. Diabetes care. 2007;30(12):3023-5.
3. Miller KM, Beck RW, Bergenstal RM, Goland RS, Haller MJ, McGill JB, et al. Evidence of a strong association between frequency of self-monitoring of blood glucose and hemoglobin A1c levels in T1D exchange clinic registry participants. Diabetes care. 2013;36(7):2009-14.
4. Norgaard K, Scaramuzza A, Bratina N, Lalic NM, Jarosz-Chobot P, Kocsis G, et al. Routine sensor-augmented pump therapy in type 1 diabetes: the INTERPRET study. Diabetes technology & therapeutics. 2013;15(4):273-80.
5. Bohn B, Karges B, Vogel C, Otto KP, Marg W, Hofer SE, et al. 20 Years of Pediatric Benchmarking in Germany and Austria: Age-Dependent Analysis of Longitudinal Follow-Up in 63,967 Children and Adolescents with Type 1 Diabetes. PLoS One. 2016;11(8):e0160971.
6. Schwandt A, Best F, Biester T, Grunerbel A, Kopp F, Krakow D, et al. Both the frequency of HbA1c testing and the frequency of self-monitoring of blood glucose predict metabolic control: A multicentre analysis of 15 199 adult type 1 diabetes patients from Germany and Austria. Diabetes Metab Res Rev. 2017;33(7).
7. Charleer S, Mathieu C, Nobels F, Gillard P. Accuracy and precision of flash glucose monitoring sensors inserted into the abdomen and upper thigh compared with the upper arm. Diabetes, obesity & metabolism. 2018.
8. Landau Z, Abiri S, Gruber N, Levy-Shraga Y, Brener A, Lebenthal Y, et al. Use of flash glucose-sensing technology (FreeStyle Libre) in youth with type 1 diabetes: AWeSoMe study group real-life observational experience. Acta diabetologica. 2018;55(12):1303-10.
9. DiMeglio LA, Acerini CL, Codner E, Craig ME, Hofer SE, Pillay K, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes. Pediatric diabetes. 2018;19 Suppl 27:105-14.
10. Beck RW, Bergenstal RM, Riddlesworth TD, Kollman C, Li Z, Brown AS, et al. Validation of Time in Range as an Outcome Measure for Diabetes Clinical Trials. Diabetes care. 2019;42(3):400-5.
11. Pouwer F, Geelhoed-Duijvestijn PH, Tack CJ, Bazelmans E, Beekman AJ, Heine RJ, et al. Prevalence of comorbid depression is high in out-patients with Type 1 or Type 2 diabetes mellitus. Results from three out-patient clinics in the Netherlands. Diabet Med. 2010;27(2):217-24.
12. Snoek FJ, Bremmer MA, Hermanns N. Constructs of depression and distress in diabetes: time for an appraisal. The lancet Diabetes & endocrinology. 2015;3(6):450-60.
13. Milton B, Holland P, Whitehead M. The social and economic consequences of childhood-onset Type 1 diabetes mellitus across the lifecourse: a systematic review. Diabet Med. 2006;23(8):821-9.
14. Steen Carlsson K, Landin-Olsson M, Nystrom L, Arnqvist HJ, Bolinder J, Ostman J, et al. Long-term detrimental consequences of the onset of type 1 diabetes on annual earnings--evidence from annual registry data in 1990-2005. Diabetologia. 2010;53(6):1084-92.
15. Bardage C, Persson I, Ortqvist A, Bergman U, Ludvigsson JF, Granath F. Neurological and autoimmune disorders after vaccination against pandemic influenza A (H1N1) with a monovalent adjuvanted vaccine: population based cohort study in Stockholm, Sweden. Bmj. 2011;343:d5956.
16. Persson S, Dahlquist G, Gerdtham UG, Steen Carlsson K. Impact of childhood-onset type 1 diabetes on schooling: a population-based register study. Diabetologia. 2013;56(6):1254-62.
17. Persson S, Dahlquist G, Gerdtham U, Steen Carlsson K. Investigating sickness absence as a pathway behind labor market consequences of childhood onset type 1 diabetes mellitus. Diabetologia. 2015;58(1 supplement 1):#853.
18. Persson S, Dahlquist G, Gerdtham UG, Steen Carlsson K, Swedish Childhood Diabetes Study G. Why childhood-onset type 1 diabetes impacts labour market outcomes: a mediation analysis. Diabetologia. 2018;61(2):342-53.
19. McKnight JA, Wild SH, Lamb MJ, Cooper MN, Jones TW, Davis EA, et al. Glycaemic control of Type 1 diabetes in clinical practice early in the 21st century: an international comparison. Diabet Med. 2015;32(8):1036-50.
20. Patterson CC, Harjutsalo V, Rosenbauer J, Neu A, Cinek O, Skrivarhaug T, et al. Trends and cyclical variation in the incidence of childhood type 1 diabetes in 26 European centres in the 25 year period 1989-2013: a multicentre prospective registration study. Diabetologia. 2019;62(3):408-17.
21. Secrest AM, Becker DJ, Kelsey SF, Laporte RE, Orchard TJ. Cause-specific mortality trends in a large population-based cohort with long-standing childhood-onset type 1 diabetes. Diabetes. 2010;59(12):3216-22.
22. Bjornstad P, Donaghue KC, Maahs DM. Macrovascular disease and risk factors in youth with type 1 diabetes: time to be more attentive to treatment? The lancet Diabetes & endocrinology. 2018;6(10):809-20.
23. Patterson CC, Dahlquist G, Harjutsalo V, Joner G, Feltbower RG, Svensson J, et al. Early mortality in EURODIAB population-based cohorts of type 1 diabetes diagnosed in childhood since 1989. Diabetologia. 2007;50(12):2439-42.
24. Livingstone SJ, Levin D, Looker HC, Lindsay RS, Wild SH, Joss N, et al. Estimated life expectancy in a Scottish cohort with type 1 diabetes, 2008-2010. JAMA. 2015;313(1):37-44.
25. Huo L, Harding JL, Peeters A, Shaw JE, Magliano DJ. Life expectancy of type 1 diabetic patients during 1997-2010: a national Australian registry-based cohort study. Diabetologia. 2016;59(6):1177-85.
26. Rawshani A, Sattar N, Franzen S, Rawshani A, Hattersley AT, Svensson AM, et al. Excess mortality and cardiovascular disease in young adults with type 1 diabetes in relation to age at onset: a nationwide, register-based cohort study. Lancet. 2018;392(10146):477-86.
27. Peyrot M, Burns KK, Davies M, Forbes A, Hermanns N, Holt R, et al. Diabetes Attitudes Wishes and Needs 2 (DAWN2): a multinational, multi-stakeholder study of psychosocial issues in diabetes and person-centred diabetes care. Diabetes Res Clin Pract. 2013;99(2):174-84.
28. Pouwer F, Nefs G, Nouwen A. Adverse effects of depression on glycemic control and health outcomes in people with diabetes: a review. Endocrinology and metabolism clinics of North America. 2013;42(3):529-44.
29. DeSalvo DJ, Miller KM, Hermann JM, Maahs DM, Hofer SE, Clements MA, et al. Continuous glucose monitoring and glycemic control among youth with type 1 diabetes: International comparison from the T1D Exchange and DPV Initiative. Pediatric diabetes. 2018;19(7):1271-5.
30. Harding JL, Shaw JE, Peeters A, Guiver T, Davidson S, Magliano DJ. Mortality trends among people with type 1 and type 2 diabetes in Australia: 1997-2010. Diabetes care. 2014;37(9):2579-86.
31. Lind M, Svensson AM, Kosiborod M, Gudbjornsdottir S, Pivodic A, Wedel H, et al. Glycemic control and excess mortality in type 1 diabetes. The New England journal of medicine. 2014;371(21):1972-82.
32. Harding JL, Shaw JE, Peeters A, Guiver T, Davidson S, Magliano DJ. Mortality trends among people with type 1 and type 2 diabetes in Australia: 1997-2010. Diabetes Care 2014;37:2579-2586. Diabetes care. 2015;38(4):733-4.
33. Petrie D, Lung TW, Rawshani A, Palmer AJ, Svensson AM, Eliasson B, et al. Recent trends in life expectancy for people with type 1 diabetes in Sweden. Diabetologia. 2016;59(6):1167-76.
34. Lacy ME, Gilsanz P, Karter AJ, Quesenberry CP, Pletcher MJ, Whitmer RA. Long-term Glycemic Control and Dementia Risk in Type 1 Diabetes. Diabetes care. 2018;41(11):2339-45.
35. Gehr B. [Is the era of blood glucose over? A clinical update to modern glucose sensors in diabetes (FGM, CGM)]. MMW Fortschritte der Medizin. 2019;161(4):53-8.
36. Gehr B, Holder M, Kulzer B, Lange K, Liebl A, Sahm C, et al. Spectrum. J Diabetes Sci Technol. 2017;11(2):284-9.
37. Soupal J, Petruzelkova L, Flekac M, Pelcl T, Matoulek M, Dankova M, et al. Comparison of Different Treatment Modalities for Type 1 Diabetes, Including Sensor-Augmented Insulin Regimens, in 52 Weeks of Follow-Up: A COMISAIR Study. Diabetes technology & therapeutics. 2016;18(9):532-8.
38. Litchman ML, Allen NA. Real-Time Continuous Glucose Monitoring Facilitates Feelings of Safety in Older Adults With Type 1 Diabetes: A Qualitative Study. J Diabetes Sci Technol. 2017;11(5):988-95.
39. Paris I, Henry C, Pirard F, Gerard AC, Colin IM. The new FreeStyle libre flash glucose monitoring system improves the glycaemic control in a cohort of people with type 1 diabetes followed in real-life conditions over a period of one year. Endocrinol Diabetes Metab. 2018;1(3):e00023.
40. Messaaoui A, Tenoutasse S, Crenier L. Flash Glucose Monitoring Accepted in Daily Life of Children and Adolescents with Type 1 Diabetes and Reduction of Severe Hypoglycemia in Real-Life Use. Diabetes technology & therapeutics. 2019.
41. Vigersky RA. The Benefits, Limitations, and Cost-Effectiveness of Advanced Technologies in the Management of Patients With Diabetes Mellitus. J Diabetes Sci Technol. 2015.
42. Fonda SJ, Graham C, Munakata J, Powers JM, Price D, Vigersky RA. The Cost-Effectiveness of Real-Time Continuous Glucose Monitoring (RT-CGM) in Type 2 Diabetes. J Diabetes Sci Technol. 2016;10(4):898-904.
43. Gomez AM, Alfonso-Cristancho R, Orozco JJ, Lynch PM, Prieto D, Saunders R, et al. Clinical and economic benefits of integrated pump/CGM technology therapy in patients with type 1 diabetes in Colombia. Endocrinol Nutr. 2016;63(9):466-74.
44. Roze S, Smith-Palmer J, Valentine WJ, Cook M, Jethwa M, de Portu S, et al. Long-term health economic benefits of sensor-augmented pump therapy vs continuous subcutaneous insulin infusion alone in type 1 diabetes: a U.K. perspective. Journal of medical economics. 2016;19(3):236-42.
45. Jendle J, Smith-Palmer J, Delbaere A, de Portu S, Papo N, Valentine W, et al. Cost-Effectiveness Analysis of Sensor-Augmented Insulin Pump Therapy with Automated Insulin Suspension Versus Standard Insulin Pump Therapy in Patients with Type 1 Diabetes in Sweden. Diabetes Ther. 2017;8(5):1015-30.
46. Conget I, Martin-Vaquero P, Roze S, Elias I, Pineda C, Alvarez M, et al. Cost-effectiveness analysis of sensor-augmented pump therapy with low glucose-suspend in patients with type 1 diabetes mellitus and high risk of hypoglycemia in Spain. Endocrinol Diabetes Nutr. 2018;65(7):380-6.
47. Garcia-Lorenzo B, Rivero-Santana A, Vallejo-Torres L, Castilla-Rodriguez I, Garcia-Perez S, Garcia-Perez L, et al. Cost-effectiveness analysis of real-time continuous monitoring glucose compared to self-monitoring of blood glucose for diabetes mellitus in Spain. J Eval Clin Pract. 2018;24(4):772-81.
48. Nicolucci A, Rossi MC, D'Ostilio D, Delbaere A, de Portu S, Roze S. Cost-effectiveness of sensor-augmented pump therapy in two different patient populations with type 1 diabetes in Italy. Nutr Metab Cardiovasc Dis. 2018;28(7):707-15.
49. Roze S, Smith-Palmer J, de Portu S, Delbaere A, de Brouwer B, de Valk HW. Cost-effectiveness of sensor-augmented insulin pump therapy vs continuous subcutaneous insulin infusion in patients with type 1 diabetes in the Netherlands. Clinicoecon Outcomes Res. 2019;11:73-82.
50. Guilmin-Crepon S, Carel JC, Schroedt J, Sulmont V, Salmon AS, Le Tallec C, et al. Is there an optimal strategy for real-time continuous glucose monitoring in pediatrics? A 12-month French multi-center, prospective, controlled randomized trial (Start-In!). Pediatric diabetes. 2019;20(3):304-13.
51. Deiss D, Bolinder J, Riveline JP, Battelino T, Bosi E, Tubiana-Rufi N, et al. Improved glycemic control in poorly controlled patients with type 1 diabetes using real-time continuous glucose monitoring. Diabetes care. 2006;29(12):2730-2.
52. Wong JC, Foster NC, Maahs DM, Raghinaru D, Bergenstal RM, Ahmann AJ, et al. Real-time continuous glucose monitoring among participants in the T1D Exchange clinic registry. Diabetes care. 2014;37(10):2702-9.
53. Bolinder J, Antuna R, Geelhoed-Duijvestijn P, Kroger J, Weitgasser R. Novel glucose-sensing technology and hypoglycaemia in type 1 diabetes: a multicentre, non-masked, randomised controlled trial. Lancet. 2016;388(10057):2254-63.
54. Aleppo G, Ruedy KJ, Riddlesworth TD, Kruger DF, Peters AL, Hirsch I, et al. REPLACE-BG: A Randomized Trial Comparing Continuous Glucose Monitoring With and Without Routine Blood Glucose Monitoring in Adults With Well-Controlled Type 1 Diabetes. Diabetes care. 2017;40(4):538-45.
55. Lind M, Polonsky W, Hirsch IB, Heise T, Bolinder J, Dahlqvist S, et al. Continuous Glucose Monitoring vs Conventional Therapy for Glycemic Control in Adults With Type 1 Diabetes Treated With Multiple Daily Insulin Injections: The GOLD Randomized Clinical Trial. JAMA. 2017;317(4):379-87.
56. Burckhardt MA, Roberts A, Smith GJ, Abraham MB, Davis EA, Jones TW. The Use of Continuous Glucose Monitoring With Remote Monitoring Improves Psychosocial Measures in Parents of Children With Type 1 Diabetes: A Randomized Crossover Trial. Diabetes care. 2018;41(12):2641-3.
57. Heinemann L, Freckmann G, Ehrmann D, Faber-Heinemann G, Guerra S, Waldenmaier D, et al. Real-time continuous glucose monitoring in adults with type 1 diabetes and impaired hypoglycaemia awareness or severe hypoglycaemia treated with multiple daily insulin injections (HypoDE): a multicentre, randomised controlled trial. Lancet. 2018;391(10128):1367-77.
58. Sandy JL, Nyunt O, Woodhead HJ, Youde LS, Ramjan KA, Jack MM, et al. Sydney Diabetes centre's experience of the Australian Government's roll out of subsidised continuous glucose monitoring for children with type 1 diabetes mellitus. Journal of paediatrics and child health. 2018.
59. Burckhardt MA, Chetty T, Smith GJ, Adolfsson P, de Bock M, Jones TW, et al. Use of Continuous Glucose Monitoring Trends to Facilitate Exercise in Children with Type 1 Diabetes. Diabetes technology & therapeutics. 2019;21(1):51-5.
60. Hermanns N, Heinemann L, Freckmann G, Waldenmaier D, Ehrmann D. Impact of CGM on the Management of Hypoglycemia Problems: Overview and Secondary Analysis of the HypoDE Study. J Diabetes Sci Technol. 2019:1932296819831695.
61. Mulinacci G, Alonso GT, JK S-B, VN S. Glycemic Outcomes with Early Initiation of Continuous Glucose Monitoring System in Recently Diagnosed Patients with Type 1 Diabetes. 2019;21(1):6-10.
62. Ng SM, Moore HS, Clemente MF, Pintus D, Soni A. Continuous Glucose Monitoring in Children with Type 1 Diabetes Improves Well-Being, Alleviates Worry and Fear of Hypoglycemia. Diabetes technology & therapeutics. 2019;21(3):133-7.
63. Picard S, Bonnemaison-Gilbert E, Leutenegger E, Barat P. Optimization of insulin regimen and glucose outcomes with short-term real-time continuous glucose monitoring (RT-CGM) in type 1 diabetic children with sub-optimal glucose control on multiple daily injections: The pediatric DIACCOR study. Arch Pediatr. 2019;26(2):95-101.
64. Senn JD, Fischli S, Slahor L, Schelbert S, Henzen C. Long-Term Effects of Initiating Continuous Subcutaneous Insulin Infusion (CSII) and Continuous Glucose Monitoring (CGM) in People with Type 1 Diabetes and Unsatisfactory Diabetes Control. J Clin Med. 2019;8(3).
65. Vinals C, Quiros C, Gimenez M, Conget I. Real-Life Management and Effectiveness of Insulin Pump with or Without Continuous Glucose Monitoring in Adults with Type 1 Diabetes. Diabetes Ther. 2019.
66. Foster NC, Beck RW, Miller KM, Clements MA, Rickels MR, DiMeglio LA, et al. State of Type 1 Diabetes Management and Outcomes from the T1D Exchange in 2016-2018. Diabetes technology & therapeutics. 2019;21(2):66-72.
67. Gomez AM, Marin Carrillo LF, Munoz Velandia OM, Rondon Sepulveda MA, Arevalo Correa CM, Mora Garzon E, et al. Long-Term Efficacy and Safety of Sensor Augmented Insulin Pump Therapy with Low-Glucose Suspend Feature in Patients with Type 1 Diabetes. Diabetes technology & therapeutics. 2017;19(2):109-14.
68. Beato-Vibora PI, Quiros-Lopez C, Lazaro-Martin L, Martin-Frias M, Barrio-Castellanos R, Gil-Poch E, et al. Impact of Sensor-Augmented Pump Therapy with Predictive Low-Glucose Suspend Function on Glycemic Control and Patient Satisfaction in Adults and Children with Type 1 Diabetes. Diabetes technology & therapeutics. 2018;20(11):738-43.
69. Gomez AM, Henao DC, Imitola A, Munoz OM, Sepulveda MAR, Kattah L, et al. Efficacy and safety of sensor-augmented pump therapy (SAPT) with predictive low-glucose management in patients diagnosed with type 1 diabetes mellitus previously treated with SAPT and low glucose suspend. Endocrinol Diabetes Nutr. 2018;65(8):451-7.
70. Matsuoka A, Hirota Y, Urai S, Hamaguchi T, Takeuchi T, Miura H, et al. Effect of switching from conventional continuous subcutaneous insulin infusion to sensor augmented pump therapy on glycemic profile in Japanese patients with type 1 diabetes. Diabetol Int. 2018;9(3):201-7.
71. Gomez AM, Marin Carrillo LF, Arevalo Correa CM, Munoz Velandia OM, Rondon Sepulveda MA, Silva Herrera JL, et al. Maternal-Fetal Outcomes in 34 Pregnant Women with Type 1 Diabetes in Sensor-Augmented Insulin Pump Therapy. Diabetes technology & therapeutics. 2017;19(7):417-22.
72. Beato-Vibora PI, Arroyo-Diez FJ. Optimal glycaemic control during caesarean section provided by sensor-augmented pump therapy with predictive low-glucose suspend function. Acta diabetologica. 2018;55(10):1083-5.
73. Steineck I, Cederholm J, Eliasson B, Rawshani A, Eeg-Olofsson K, Svensson AM, et al. Insulin pump therapy, multiple daily injections, and cardiovascular mortality in 18,168 people with type 1 diabetes: observational study. BMJ. 2015;350:h3234.
74. Burckhardt MA, Smith GJ, Cooper MN, Jones TW, Davis EA. Real-world outcomes of insulin pump compared to injection therapy in a population-based sample of children with type 1 diabetes. Pediatric diabetes. 2018;19(8):1459-66.
75. Forlenza GP, Ekhlaspour L, Breton M, Maahs DM, Wadwa RP, DeBoer M, et al. Successful At-Home Use of the Tandem Control-IQ Artificial Pancreas System in Young Children During a Randomized Controlled Trial. Diabetes technology & therapeutics. 2019;21(4):159-69.
76. Buckingham BA, Christiansen MP, Forlenza GP, Wadwa RP, Peyser TA, Lee JB, et al. Performance of the Omnipod Personalized Model Predictive Control Algorithm with Meal Bolus Challenges in Adults with Type 1 Diabetes. Diabetes technology & therapeutics. 2018;20(9):585-95.
77. Forlenza GP, Buckingham BA, Christiansen MP, Wadwa RP, Peyser TA, Lee JB, et al. Performance of Omnipod Personalized Model Predictive Control Algorithm with Moderate Intensity Exercise in Adults with Type 1 Diabetes. Diabetes technology & therapeutics. 2019;21(5):265-72.
78. Benhamou P, Franc S, Reznik Y, Thivolet C, Schaepelynck P, al. e. Closed-loop insulin delivery in adults with type 1 diabetes in real-life conditions: a 12-week multicentre, open-label randomised controlled crossover trial. Lancet Digital Health. 2019;1:e17–25.
79. Stone MP, Agrawal P, Chen X, Liu M, Shin J, Cordero TL, et al. Retrospective Analysis of 3-Month Real-World Glucose Data After the MiniMed 670G System Commercial Launch. Diabetes technology & therapeutics. 2018;20(10):689-92.
80. de Bock M, Dart J, Hancock M, Smith G, Davis EA, Jones TW. Performance of Medtronic Hybrid Closed-Loop Iterations: Results from a Randomized Trial in Adolescents with Type 1 Diabetes. Diabetes technology & therapeutics. 2018;20(10):693-7.
81. de Bock M, McAuley SA, Abraham MB, Smith G, Nicholas J, Ambler GR, et al. Effect of 6 months hybrid closed-loop insulin delivery in young people with type 1 diabetes: a randomised controlled trial protocol. BMJ open. 2018;8(8):e020275.
82. Forlenza GP, Pinhas-Hamiel O, Liljenquist DR, Shulman DI, Bailey TS, Bode BW, et al. Safety Evaluation of the MiniMed 670G System in Children 7-13 Years of Age with Type 1 Diabetes. Diabetes technology & therapeutics. 2019;21(1):11-9.
83. Lewis D, Leibrand S, Open APSC. Real-World Use of Open Source Artificial Pancreas Systems. J Diabetes Sci Technol. 2016;10(6):1411.
84. Lee JM, Newman MW, Gebremariam A, Choi P, Lewis D, Nordgren W, et al. Real-World Use and Self-Reported Health Outcomes of a Patient-Designed Do-it-Yourself Mobile Technology System for Diabetes: Lessons for Mobile Health. Diabetes technology & therapeutics. 2017;19(4):209-19.
85. Lewis D. Setting Expectations for Successful Artificial Pancreas/Hybrid Closed Loop/Automated Insulin Delivery Adoption. J Diabetes Sci Technol. 2018;12(2):533-4.